Per què el mesurem
L'amoni és una de les formes en què el nitrogen inorgànic es pot trobar als sistemes aquàtics. L'amoni és la forma més reduïda en què trobem el nitrogen a l'aigua (cicle del nitrogen). En aigües naturals, ben oxigenades, l'amoni sol representar el 13% del nitrogen inorgànic total, i és la forma nitrogenada més utilitzada per molts productors primaris, bacteris i fongs. La seva biodisponibilitat per als organismes autòtrofs, doncs, és important, però cal tenir en compte que, quan apareix en concentracions massa elevades, pot esdevenir tòxic per a altres organismes. La presència de quantitats d'amoni anormalment elevades als medis aquàtics sol ser deguda a abocaments de diverses procedències, tant puntuals com difusos. Les aigües residuals no depurades poden aportar amoni directament als rius, així com les aigües que provenen d'estacions depuradores convencionals, tant de tipus fisicoquímic com biològic. L'amoni també pot procedir de l'agricultura, per via difusa; aquestes entrades als sistemes fluvials són encara més difícils de controlar o tractar que les entrades puntuals. La presència d'amoni, però, també es pot deure de manera indirecta a aportacions d'altres formes nitrogenades, principalment nitrats. Les elevades concentracions de nitrats al medi afavoreixen una producció primària molt elevada, que pot contribuir a esgotar l'oxigen dissolt a l'aigua i que, de retruc, comporta la transformació del nitrat en amoni.
L'amoni és tòxic per a molts organismes aquàtics en concentracions relativament baixes i en medi aquós l'amoni està reaccionant amb l'aigua segons la fórmula següent, que es manté en equilibri si no varia el pH ni la temperatura:
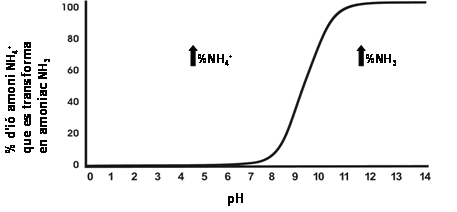
Aquesta reacció es veu desplaçada segons el pH del medi seguint una tendència com la del gràfic de la dreta.
A partir d’un pH de 7 o 8, l’amoni (NH4+) té molta més tendència a perdre un protó (H+) i passar a amoníac (NH3), que és la forma més tòxica per als organismes vius.
Pel que fa als macroinvertebrats, s'observa la reducció de la biodiversitat en presència d'amoni en concentracions properes a 1 mg/l. En concentracions fins i tot més baixes, es veuen fortament afectades les poblacions de peixos. De forma general, podem dir que en concentracions inferiors a 0,1 mg/l la vida aquàtica no es veu afectada. Entre 0,1 i 0,4 mg/l, concentracions que es poden trobar de manera natural en determinats ambients, tampoc no s'observa toxicitat si el pH es manté entre 6 i 8, però pot haver-hi risc a pH superiors a 8. Entre 0,4 i 1 mg/l, encara es permet la vida dels peixos ciprínids, però poden començar a aparèixer símptomes de toxicitat depenent del pH, especialment per als salmònids. Finalment, per sobre d'1 mg/l d'amoni, tant els peixos com els macroinvertebrats es veuen afectats, i és per damunt dels 4 mg/l que la toxicitat es considera molt forta (vegeu la taula de llegenda).
Com el mesurem
La determinació de la concentració d’amoni es realitza al laboratoris i els resultats es mostren en mg N-NH4+/l.
Com el representem
Les concentracions d'amoni es representen als mapes de resultats en cinc rangs que, a grans trets, poden indicar-nos el grau de toxicitat d'aquest contaminant per als organismes:
|
Símbol
|
Concentració Amoni (mg N-NH3/l) |
Interpretació
|
 |
< 0.1 |
Aigües netes. Sense risc de toxicitat per als organismes. |
 |
0,1 - 0,4 | Aigües on el risc de toxicitat pot ser significatiu depenent del pH i del temps de permanència. |
 |
0,5 - 0,9 |
Aigües amb risc de toxicitat si el pH és alt. |
 |
1-4 | Aigües que comporten un risc de toxicitat elevat per a moltes espècies, sobretot a pH > 8. |
 |
> 4 |
Aigües amb un grau de toxicitat agut per als organismes. |
