Comité de Ética de la Investigación Clínica (CEIC) y diseminación pública de los resultados de la investigación
Carlos Sala
Mateus
Doctor en Medicina. Especialista en Medicina Interna. Máster
en Bioética y Derecho UB. Miembro del Comitè d’Ètica de la Investigació
Clínica del Maresme. Jefe de la Unidad de Investigación, Corporació de Salut
del Maresme i la Selva.
En esta sección tienen cabida las aportaciones de los alumnos del Máster en Bioética y Derecho de la Universitat de Barcelona, de la presente edición (XIII promoción 2010-2012) así como de ediciones anteriores. Esperamos vuestras contribuciones en obd[@]pcb.ub.es.
Resumen
Solamente los resultados de los estudios publicados están a disposición de la comunidad científica para orientar futuras investigaciones y para la revisión de la evidencia disponible. Sin embargo, no todos los estudios clínicos se publican, lo cual puede distorsionar la evidencia disponible en la literatura. Hemos realizado un seguimiento de los proyectos enviados al comité de ética de la investigación clínica (CEIC) del Maresme (Catalunya), desde 2001 a 2005. Se ha estudiado la tasa de publicación y los factores asociados. Se realizó una búsqueda de las publicaciones completas en diversas bases de datos, y se analizaron los informes de seguimiento. En este periodo, el CEIC recibió 179 proyectos, de los cuales 157 fueron aprobados, y 98 se llevaron a cabo. La tasa de publicación fue del 62%, en un tiempo medio de, aproximadamente 4 años. Los hallazgos sugieren que los estudios confirmatorios tienen una mayor probabilidad de publicación, y más rápidamente, que los negativos. Estos resultados son similares a los obtenidos en otros estudios. Una estrecha monitorización de los estudios hasta su conclusión/publicación y un adecuado soporte a los investigadores, podría ser de ayuda para mejorar la tasa de publicación de la investigación.
Palabras clave
Ensayos clínicos; Ensayos farmacológicos; Publicación completa; Sesgo de publicación; Sesgo de diseminación; Tasa de publicación.
Summary
Only data of published study results are available to the scientific community for further use such as informing future research and synthesis of available evidence. However, not all clinical trials are published, which may distort the evidence that is available in the literature. We assessed the output of clinical research projects submitted to the research ethics committee (REC) of Maresme (Catalonia), from 2001 to 2005. We studied the publication rate of this cohort and identified factors associated with it. Published full articles in several databases were searched and we analysed follow-up information. In this periode, our REC reviewed 179 projects, 157 were approved, and 98 were finished. Publication rate was 62%, in a mean time to be publicated about four years. The finding suggests that studies with confirmatory results were more likely to be published and more quickly than studies with negative results. These results are similar to others studies. Close monitoring of projects until publication and, adequate support provided to investigators, could help to improve publication rate of research.
Key words
Clinical trials; Drug trials; Full publication; Reporting biases; Dissemination biases; Publication rate.
Introducción
Los avances en la ciencia biomédica y la tecnología, y su aplicación práctica en la medicina, provocan una cierta inquietud en la sociedad, y nos enfrentan a dilemas éticos nuevos. La sociedad se muestra preocupada ante la posibilidad de posibles abusos en la investigación científica, lo cual es comprensible, dada la compleja metodología utilizada. La investigación se inicia con una hipótesis, la cual se pone a prueba en los laboratorios y, si es necesario, con animales de experimentación. Posteriormente, para obtener unos resultados extrapolables y clínicamente útiles, se deben realizar en seres humanos y, aunque el diseño sea muy cuidadoso, siempre conlleva algún riesgo para los sujetos. Este riesgo no se justifica por la obtención de beneficios para el investigador, el promotor o la institución que lo alberga, ni tan siquiera para la sociedad, sino únicamente por sus beneficios en los seres humanos involucrados, y su contribución al conocimiento, para aliviar el sufrimiento o prolongar la vida. La sociedad ha elaborado unas medidas para protegerse de posibles abusos, como son los códigos de conducta (1-10) y las normas legislativas (11-18). Y para garantizar su seguimiento, cualquier proyecto debe ser evaluado antes de su inicio, desde una perspectiva científica, ética y legal, por órganos debidamente constituidos, independientes de los investigadores, como el CEIC.
En cuanto a la vertiente ética de la investigación, se han propuesto determinadas exigencias de aplicación universal. Los ensayos clínicos cumplen el requisito de valor social cuando estudian la eficacia y seguridad de una intervención, por tanto, la no difusión de sus resultados, sean del signo que sean, niega la noción de valor social (19). Además, pueden contener componentes terapéuticos y no terapéuticos, y hay que garantizar el mínimo riesgo posible a los participantes. Ambos componentes deben evaluarse sistemáticamente por separado; los riesgos terapéuticos se pueden justificar mediante el cálculo riesgo-beneficio, y los derivados de los no terapéuticos, a través del cálculo riesgo-adquisición de conocimiento. Así pues, la no difusión de los conocimientos adquiridos niega la asunción de los riesgos (20). Además, diversas encuestas han mostrado que la participación en ensayos clínicos está motivada básicamente por tres factores: la obtención anticipada de beneficios directos, la percepción que la invitación a participar es una recomendación positiva por el asesor de confianza, y la asunción que la investigación ayudará a futuros pacientes. Por tanto, la difusión pública de los conocimientos adquiridos es un requisito esencial e inviolable. También, los participantes tienen derecho a conocer los resultados y sus implicaciones (21,22). Finalmente, la no publicación de los resultados de la investigación puede perjudicar a futuros pacientes, debido a su efecto sobre las revisiones sistemáticas, y sobre participantes en futuros ensayos, los cuales pueden estar expuestos a estudios duplicados o irrelevantes, con intervenciones que se saben ineficaces o incluso peligrosas (23). En resumen, los imperativos éticos que obligan a la difusión pública de los resultados, aplicables a todas las formas de investigación realizadas en seres humanos (24-26), son:
- El requisito ético de “valor social” presupone la difusión de los resultados.
- La inclusión de componentes no terapéuticos en la investigación, únicamente está justificada por la adquisición de conocimientos nuevos relevantes.
- La difusión es necesaria para la producción de revisiones sistemáticas y metanálisis, las cuales han de ser pertinentes, adecuadas y fiables.
- La difusión pública reconoce la motivación altruista de los pacientes que han aceptado participar en el proyecto.
- Los participantes tienen derecho a conocer los resultados del estudio en el que han accedido a participar.
- La difusión se ajusta al código de conducta ética sobre el uso compartido de los conocimientos con los colegas.
Se han realizado varios estudios de seguimiento sobre proyectos de investigación aprobados por diversos CEICs u otros organismos reguladores, en los cuales se ha mostrado que los estudios concluidos presentan unas tasas en la publicación de sus resultados muy variables. El objetivo principal de este estudio ha sido el de determinar la tasa de publicaciones surgidas de los proyectos de investigación aprobados por el CEIC de Mataró durante 5 años (2001-2005), una vez concluidos, y determinar sus posibles asociaciones.
Material y métodos
Esta revisión se realizó en el CEIC de Mataró, donde están archivados los protocolos presentados para su evaluación. Se han seleccionado los proyectos presentados entre el primero de enero de 2001 y el 31 de diciembre de 2005. De todos ellos, se han seleccionado únicamente los que fueron aprobados, se iniciaron, realizaron y finalmente, fueron concluidos. Los datos recogidos fueron el código asignado al proyecto, la fecha de evaluación por el CEIC y su resolución, el título del proyecto, el tipo de estudio, y sus características, la especialidad, el promotor, su financiación y fuente, en caso de suspensión, la fecha y el motivo, y el informe final.
En todos los estudios concluidos se realizó una búsqueda a través de Internet, para detectar si había informes científicos no publicados en revistas científicas, comunicaciones y/o publicaciones que no constasen en el informe final. Esta búsqueda se realizó en las bases de datos científicas más importantes (MEDLINE, EBSCO, OVID, ProQuest, EMBASE y Cochrane), también, utilizando palabras clave del estudio, código, ciudad, investigador y a través de buscadores generales (Google, Yahoo,…). Los estudios experimentales concluidos fueron clasificados según el resultado obtenido, en función de si el resultado apoyaba la hipótesis inicial de mejora, que se clasificó como positivo, si no mostraba beneficios, pero tampoco perjuicios, o confirmaba la hipótesis inicial de no inferioridad, se clasificó de igualdad, o si se obtuvieron resultados negativos, en cuyo caso consta como negativo.
En cuanto a la difusión de los resultados, se han tenido en cuenta las presentaciones en conferencias, o en formato de resumen/abstract orales o en pósters, a través de artículos de revisión, capítulos de libros, tesis doctorales, etc., que los investigadores hicieran constar, con el título, autor, lugar y fecha. Sin embargo, las publicaciones completas fueron definidas como el trabajo en formato de artículo publicado en una revista científica, indexada en MEDLINE o no, que aporta una información adecuada sobre, al menos los objetivos del estudio, así como los métodos y los resultados finales, referenciando el nombre de la revista y la fecha de publicación.
El investigador de esta revisión de comprometió a cumplir con los principios de la Declaración de Helsinki, así como a seguir las directrices de las Normas de Buena Práctica Clínica, y a proteger la intimidad de los datos, según la legislación vigente (Ley Orgánica 15/1999, del 13 de diciembre, sobre Protección de Datos de Carácter Personal).
Resultados
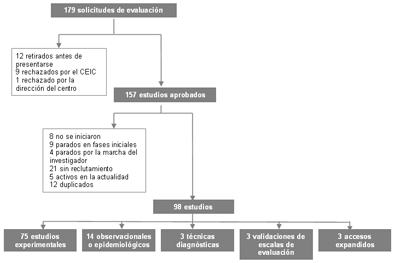
Desde el primero de enero de 2001 hasta el 31 de diciembre de 2005 solicitaron ser evaluados por el CEIC del Maresme 179 proyectos de investigación (Figura 1). De los cuales, 12 se retiraron antes de su presentación, ya sea por el promotor o el investigador principal (IP), el CEIC rechazó 9, y la dirección del centro denegó su permiso en otro. De los 157 restantes, 4 no se iniciaron por retirada del promotor o el IP antes de firmar el contrato, otro por problemas de financiación, otro por complejidad del estudio, otro por la aparición de nuevos estudios en contra de la hipótesis inicial, y otro por problemas técnicos con el placebo. El promotor o IP pararon prematuramente 9 estudios por razones diversas, y en cuatro fue debido a la marcha del IP del lugar de trabajo sin dejar un sustituto para su continuación. En 21 estudios no se reclutaron pacientes y, 5 están activos en el momento de realizar la presente revisión. Finalmente, 12 proyectos estaban duplicados por presentar un IP diferente en distintos centros a los que el mismo CEIC da cobertura. Así pues, la presente revisión se ha efectuado sobre 98 estudios concluidos, entre los que se pueden diferenciar, 75 estudios experimentales, 14 observacionales o epidemiológicos, 3 sobre técnicas diagnósticas, 3 validaciones de escales de evaluación, y 3 eran accesos expandidos a un determinado fármaco.
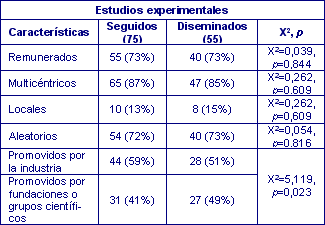
De los 75 estudios experimentales, 55 fueron comunicados a la sociedad científica, en 40 ocasiones a través de artículos publicados en revistas indexadas en MEDLINE y cinco artículos en revistas locales de la especialidad, siete informes científicos resumidos, dos en formato de comunicación presentados al congreso de la especialidad y una tesis doctoral. Distribuidos según la fase del estudio (tabla 1), no se detectaron diferencias significativas entre los estudios publicados o no (χ2= 1,48; p= 0,477); tampoco, según otras características (Tabla 2), excepto cuando el estudio había sido promovido por fundaciones o grupos científicos frente a los promocionados por la industria farmacéutica, así se publicaron 27/31 (87%) en los primeros frente a 28/44 (64%) en los segundos (p=0,023); finalmente, también se distribuyeron según la especialidad o ámbitos de trabajo (Tabla 3).
Entre los 23 restantes, había 14 estudios observacionales (dos eran locales, y 8 estaban remunerados), nueve fueron publicados en revistas científicas (7 indexadas en MEDLINE y dos locales), y dos en formato de comunicación científica al congreso de la especialidad; tres estudios sobre técnicas diagnósticas (todos ellos locales, y uno era remunerado), y dos fueron publicados en formato de artículo en revistas indexadas en MEDLINE; tres validaciones de escalas diagnósticas, uno de ellos remunerado, y dos fueron publicados en formato artículo en revistas indexadas; y finalmente, tres accesos expandidos a un determinado fármaco, dos de ellos remunerados, y los tres fueron publicados en revistas científicas indexadas.
Figura 1. Algoritmo de los proyectos
presentados al CEIC (2001-2005).
Haz clic en la imagen para ampliar.
La suma total de todos los proyectos aprobados por el CEIC y concluidos fue de 98, de los cuales 73 se comunicaron a la sociedad científica en diferentes formatos; 61 (62%) de ellos, a través de artículos en revistas indexadas en MEDLINE o locales. De ellos, solamente 15 (25%) lo fueron en revistas de lengua española (Tabla 4).
El tiempo medio transcurrido desde su aprobación por el CEIC hasta que fueron diseminados, en el caso de los estudios experimentales fue de 50,3±18,6 meses, en los observacionales de 48,4±9,4 meses, en los de acceso expandido de 62,0±2,6 meses, en los de validación de escalas, de 28,5±10,6 meses, y en los de técnicas diagnósticas de 14,0±2,8 meses. En los 55 estudios experimentales que finalmente fueron diseminados, 24 aportaban resultados positivos, 22 de igualdad o de no inferioridad, y 9 eran negativos, los cuales tardaron una media de 44,7±16,2; 54,0±21,0 y 56,4±15,5 meses en ser presentados, respectivamente, sin detectar entre ellos diferencias significativas (p=0,13).
Tabla 1. Fases de los estudios experimentales finalizados, seguidos y publicados.
Tabla 2. Características de los estudios experimentales finalizados, seguidos y publicados.
Tabla 3. Especialidad o ámbito de los estudios experimentales finalizados, seguidos y publicados.
Tabla 4. Revistas en que fueron publicados
los 61 estudios.
Haz clic en la imagen para ampliar.
Discusión
La publicación de los resultados de la investigación no es un proceso dicotómico, sino más bien se trata de un continuum que va desde la distribución de documentos y comentarios entre colegas, y en encuentros científicos, hasta su publicación completa en revistas con peer-review. Esta diseminación pública de los resultados, incluye diversos formatos, como son la ya mencionada publicación completa en revistas científicas, pasando por resúmenes presentados en congresos, conferencias, informes, capítulos de libros, discusiones, disertaciones o tesis. Sin embargo, la importancia o impacto que pueda tener la publicación de los resultados de un determinado ensayo, está asociado a su accesibilidad, y ésta depende, no solamente de si un estudio ha sido publicado, sino también de cuando, donde y en qué formato lo ha sido (27).
A menudo, los resultados de la investigación, inicialmente se presentan en forma de comunicaciones o resúmenes en reuniones o congresos científicos (28). Pero, su impacto es limitado, básicamente por la escasa información que aportan, lo cual dificulta juzgar su validez interna y externa, limita su incorporación a las revisiones sistemáticas o metanálisis y, frecuentemente, son de difícil acceso (29,30). A menudo, se han detectado resúmenes con resultados preliminares o finales, que no coinciden con los presentados en la publicación completa posterior (31-34), también, que presentan cambios en la metodología (35), incluso en la autoría (36). Es decir, que la presentación en formato de resumen o abstract no es una forma aceptable para la difusión pública de la investigación.
Se han descrito medios alternativos, como su presentación en determinados bancos de datos (37,38), o su publicación en una web vinculada a un registro de ensayos. Si bien es cierto que la publicación en Internet dificulta el control de su veracidad y calidad, al menos posibilita una más amplia difusión (39-41). Pero, la disponibilidad de estos datos, puede estar limitada por intereses sobre la propiedad intelectual (42,43), lo cual merecería un debate público. Los resultados no publicados formalmente, se denominan “literatura gris” (44-46), y la mayoría está compuesta por resúmenes, también hay disertaciones, conferencias, tesis doctorales,... Se ha abogado por incluir esta literatura, aunque con limitaciones y ciertas garantías, en las revisiones sistemáticas, para minimizar en lo posible el llamado “sesgo de publicación” (47) o indistintamente, “sesgo de diseminación”, en un intento de señalar más su relación con la accesibilidad (48).
Hoy por hoy, la mejor manera de hacer públicos los resultados de la investigación es su publicación completa en una revista científica con peer-review, e indexada en bases de datos con impacto. Pero, también es cierto, que estos requisitos no obvian la sospecha que la investigación actual esté contaminada por fraudes y engaños (49). El sesgo de publicación presenta tres etapas bien definidas: la pre-publicación que se da en el desarrollo de la investigación, ya sea por ignorancia, pereza, avaricia o trato distinto aplicado a los ensayos clínicos; el de publicación, que se refiere a la mayor probabilidad de publicar un trabajo de signo positivo, que apoya una intervención experimental y con significación estadística, sesgo que potencialmente también afecta a los editores y revisores; y el sesgo post-publicación, el cual se refiere a la interpretación de los resultados, la diseminación, las revisiones y los metanálisis (47,48,50).
En base a la legislación vigente, el CEIC está en una posición ideal para seguir la progresión de los proyectos que él ha aprobado. Se han publicado varios estudios de seguimiento sobre proyectos de investigación que diversos CEIC y entidades reguladoras habían aprobado (Tabla 5). Podemos ver que las tasas de publicación de los resultados de la investigación son muy variables, yendo desde las cifras más bajas aportadas por grupos españoles, el 20% del Hospital del Valle de Hebrón de Barcelona (51), el 31% del Hospital Clínico de Barcelona (52), y el 35% de la Mutua de Terrassa (53), pasando por el 38% de franceses (54), 44% de canadienses (55), 48% y 70% de alemanes (56,57), el 52% de ingleses (58) y suizos (59), 81% y 62% (60) de americanos, y recientemente, el 63% del grupo del Hospital del Mar de Barcelona (61), hasta el 98% en un trabajo antiguo (62). Nuestra revisión ha detectado una tasa de publicación similar a la del grupo de Espona et al. (61), que realizó un seguimiento de 7 años.
La mayoría de autores ha detectado una asociación entre la tasa de publicación y los resultados positivos o con significación estadística (58,60-63). En la presente revisión, también se detecta una asociación con los resultados positivos, ya que entre los 55 trabajos experimentales publicados, 46 (84%) mostraban resultados confirmatorios (ya sea de superioridad o de no inferioridad) y, únicamente 9 eran negativos. No obstante, hay que ser cautos en su interpretación, ya que desconocemos el signo de los resultados de los 20 trabajos concluidos no publicados.
Tabla 5. Seguimiento de proyectos aprobados
por CEICs.
Haz clic en la imagen para ampliar.
Las distintas tasas de publicación, parece que también están relacionadas con el tiempo de seguimiento. En los estudios con tasas más bajas se realizó un seguimiento de pocos años (51,52). En cambio, en el seguimiento a 10 años de los proyectos aprobados por un CEIC australiano, se habían publicado el 85% de los que mostraban resultados positivos significativos, y el 65% con resultados negativos o nulos; con una media de tiempo hasta su publicación de 4,7 años en los primeros, y de 8 años en los segundos (63). Los resultados de diversos estudios en el ámbito de la infección por el VIH se publicaron una media de 4,3 años después de iniciar el reclutamiento si los resultados eran estadísticamente significativos, y de 6,5 años, cuando los resultados habían sido negativos (64). En una revisión sistemática sobre 196 estudios, se publicaron alrededor de un 50% de los trabajos; de los cuales, si los resultados favorecían a la intervención tardaban unos 4-5 años, y cuando no era así, unos 6-8 años (65). Los mismos autores han publicado una revisión más reciente, en que detectan que la probabilidad de publicación de los estudios con resultados positivos y significación estadística es unas cuatro veces mayor, y también, que tienden a ser publicados antes, en los márgenes de tiempo antes descritos (66). En el estudio francés antes mencionado, la probabilidad de publicación era 4,6 veces mayor cuando mostraban resultados confirmatorios, en una media de 5,2 años, frente los 6,5 años de los estudios no confirmatorios (54).
Sin embargo, un aspecto no homogéneo en las distintas series es el punto de referencia inicial, para determinar el tiempo transcurrido hasta su publicación. Se ha usado la fecha de aprobación por el CEIC (54,63), el inicio del reclutamiento (64), la obtención del financiamiento (67), el final del seguimiento (55), la conclusión del trabajo (51,68), incluso desde su presentación previa en formato de resumen (69-74), y la fecha de envío del manuscrito (75). En esta revisión se ha apostado por el tiempo transcurrido desde su aprobación por el CEI hasta su publicación. Tanto en los estudios experimentales como en los observacionales se tardó, aproximadamente una media de 4 años en publicarse, cifra apuntada por otros autores. En cuanto a los experimentales, los trabajos que aportaban resultados positivos tardaron 3,7 años en ser publicados, los de igualdad 4,5 años, y los negativos 4,7 años, es decir, también se observa una tendencia a su publicación más rápida, aspecto ya sugerido por otros autores, aunque sin significación estadística (p=0,13). Sin embargo, dado el número limitado de la serie, estos resultados, aunque orientativos, deben tomarse con cautela.
Se han descrito otras asociaciones, como el volumen de la muestra (58,59), el tipo de estudio (58), u otras características (55, 59,61), aunque no todos los autores las han detectado (62). En nuestra revisión no hemos encontrado asociaciones con las características evaluadas, excepto entre los estudios promovidos por fundaciones o sociedades científicas frente a los promocionados por la industria farmacéutica (p=0,023). Entre otras razones, también creemos que ello puede ser debido al limitado número de la serie.
La importancia de estos factores depende de si los estudios publicados son representativos de todos los realizados. Si los estudios publicados son una muestra aleatoria de todos los realizados, no habrá sesgo, y la estimación de los resultados, basada en los publicados será similar o igual a la que se obtendría con todos los estudios realizados. Sin embargo, si los publicados son una muestra sesgada de todos los realizados, las estimaciones obtenidas serán engañosas (75). Por tanto, si los estudios con resultados positivos tienen más probabilidad de publicación que los que obtienen resultados negativos, ello dará lugar a que la eficacia de un tratamiento esté sobrevalorada en las revisiones sistemáticas y metanálisis (77).
Otro motivo de sesgo de publicación es la lengua de publicación. En nuestro caso hemos detectado una tendencia a publicar en revistas de lengua inglesa y con un factor de impacto elevado, tendencia también detectada por otros autores de nuestro ámbito geográfico (52,61).
Las revisiones más recientes muestran una tendencia a incrementar el porcentaje de la investigación completada que finalmente se publica o disemina a la comunidad científica y/o a la sociedad en general, que de hecho es la deudora fundamental, y beneficiaria final. Probablemente, la aparición de recientes escándalos en el ámbito de la investigación ha provocado una mayor concienciación en la sociedad en general y, la comunidad científica en particular, sobre sus graves consecuencias. Como primer paso en su prevención, se ha sugerido la necesidad que los resultados de la investigación sean de acceso público. La iniciativa más influyente en este sentido ha sido la obligatoriedad del registro prospectivo de todos los estudios (78) propuesta por el International Committee of Medical Journal Editors (79). La World Health Organization inició en 2005 un proyecto para establecer unas normas en el registro de los ensayos clínicos. Sin embargo, el desarrollo del registro prospectivo, por si mismo no es suficiente, hay que asegurar que los resultados de los estudios registrados sean de acceso público (80). Los ejemplos propuestos más extendidos han sido Clinicaltrials (81) en los Estados Unidos, o EudraCT (82) en Europa, en fase de desarrollo. También, la industria farmacéutica ha creado sus propias bases de datos, donde publican sus proyectos de investigación y los resultados obtenidos (83-86). El progresivo desarrollo del registro y la publicación electrónica, en un futuro facilitará la identificación y localización de la llamada “literatura gris”. También, ha sido de ayuda para dar una mayor transparencia, la edición de guías para homogeneizar la publicación de los trabajos, de manera que éstos contengan los elementos esenciales y facilitar las revisiones sistemáticas (87-91). Finalmente, el Committee on Publication Ethics (92) ha editado unas recomendaciones para facilitar un enfoque ético en la difusión de los resultados de la investigación.
En cuanto al papel que el CEIC debe adoptar en la promoción y difusión de los resultados de la investigación, podemos diferenciar dos etapas (tabla 6), las recomendaciones iniciales y las de seguimiento. La solicitud inicial de un proyecto de investigación debe contener una declaración de intenciones, en la cual el promotor y/o investigador se compromete, y describe, el medio por el cual piensa difundir los resultados que se obtengan, sean del signo que sean. El CEIC debe estar informado de todo ello, antes de otorgar un dictamen favorable. Este requisito sirve como aceptación de responsabilidad, por el cual deberá de rendir cuentas posteriormente.
El investigador está obligado a abstenerse de participar y a denunciar los estudios en que el promotor dispone de derechos contractuales abusivos sobre la revisión y/o modificación de los resultados, también sobre los retardos intencionados para la publicación, y si el promotor se reserva un poder de veto. Son bien conocidos los casos de censura sobre la publicación de resultados (93-95). Las diversas instituciones deben de apoyar estos esfuerzos para establecer políticas institucionales que garanticen la libertad intelectual. Finalmente, el dictamen favorable del CEIC debe estar supeditado al registro público previo, del que debe responder el promotor y/o investigador.
.Tabla 6: Recomendaciones para las acciones y los requisitos del CEIC.
Entre las funciones del CEIC está la de supervisar los trabajos en curso, para garantizar la seguridad permanente de los participantes. Éste debe requerir informes anuales sobre el progreso del estudio, o con más frecuencia si lo considera oportuno, a los promotores y/o investigadores. A la conclusión del estudio, deberán presentar un informe final. No obstante, la definición que se da habitualmente al punto de finalización resulta ambigua. En general, se acepta que ocurre cuando se han practicado todas las intervenciones relacionadas con la investigación. Sin embargo, otros autores sostienen que el CEIC debería continuar con el seguimiento hasta que los objetivos principales, previamente establecidos, hayan sido publicados. Esta definición resuelve un concepto básico sobre la actividad investigadora, la cual no se ha completado hasta que sus resultados han sido difundidos públicamente.
La ausencia de información sobre los resultados de la investigación debe considerarse como una conducta inadecuada o mala praxis (92,96). Si tras un período razonable, el CEIC observa que los resultados de un estudio completado no se han notificado, debe averiguar si los investigadores que asumieron su autoría son responsables de ello. Previamente, el CEIC había valorado positivamente la idoneidad del investigador para llevar a cabo el proyecto. El incumplimiento al deber de difusión de los resultados, deberá tenerse en cuenta en la evaluación de nuevos proyectos presentados por los investigadores. Ello no debe interpretarse como la confección de una lista negra. El CEIC tiene la responsabilidad de salvaguardar los intereses de los participantes en la investigación, y los investigadores no tienen un derecho ilimitado a la investigación con seres humanos, en cambio, si tienen una obligación en relación a ellos.
La difusión pública de los resultados de la investigación es de interés evidente para los promotores, investigadores, instituciones y consumidores. Cada uno debe asumir su papel para garantizar la difusión de los resultados. Promotores e instituciones deben hacerlo mediante unos acuerdos contractuales adecuados con los investigadores. Los grupos de consumidores pueden hacerlo, en parte, con el apoyo al registro de ensayos y el seguimiento de sus resultados. El CEIC está obligado por ley, a supervisar la investigación en seres humanos, y esto requiere del ejercicio de una crítica razonada en la aplicación de las directivas reguladoras. En este sentido, la adopción de requisitos específicos para garantizar la difusión de los resultados de la investigación, es uno de los componentes de una norma propuesta para la revisión científica y ética de los ensayos por el CEIC (26).
Bibliografía
1. Código de Nuremberg (1946) [http://www.pcb.ub.es/bioeticaidret/archivos/norm/CodigoNuremberg.pdf]
2. Declaración Universal de los Derechos Humanos (1948) [http://www.un.org/es/documents/udhr/index.shtml]
3. Declaración de Helsinki. Principios éticos para las investigaciones médicas en seres humanos. [http://www.wma.net/es/30publications/10policies/b3/index.html]
4. Informe Belmont (1979) [http://www.pcb.ub.es/bioeticaidret/archivos/norm/InformeBelmont.pdf]
5. International Ethical Guidelines for Biomedical Research Involving Human Subjects. CIOMS [http://www.cioms.ch/]
6. International Conference on Harmonisation-ICH, [http://www.ich.org/home.html]
7. Normas de buenas prácticas clínicas. CIARM, [http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/ucm073128.pdf]
8. Codi de Bones Pràctiques Científiques. UAB, [http://www.recerca.uab.es/ceeah/docs/CBPC-cat.pdf]
9. Codi de Bones Pràctiques en Recerca. UB, [http://www.ub.edu/agenciaqualitat/doc/codibonespractiques.pdf]
10. Guia de Bona Pràctica en la Recerca en Ciències de la Salut. ICS, [http://www.gencat.cat/ics/professionals/pdf/bprecerca.pdf]
11. EudraLex - Volume 10 Clinical trials guidelines [http://ec.europa.eu/health/documents/eudralex/vol-10/index_en.htm]
12. Normativas sobre ensayos clínicos con medicamentos de uso humano. AEMPS [http://www.aemps.es/actividad/invClinica/ensayosClinicos.htm]
13. Directives, Guidance and Forms. EudraCT Supporting Documentation [https://eudract.ema.europa.eu/document.html]
14. Ley 15/12999, de 13 de diciembre, de Protección de Datos de Carácter Personal [http://www.boe.es/boe/dias/1999/12/14/pdfs/A43088-43099.pdf]
15. Real Decreto 223/2004, de 6 de febrero, por el que se regulan los ensayos clínicos con medicamentos [http://www.boe.es/boe/dias/2004/02/07/pdfs/A05429-05443.pdf]
16. Ley 14/2007, de 3 de julio, de Investigación biomédica [http://www.boe.es/boe/dias/2007/07/04/pdfs/A28826-28848.pdf]
17. Orden SAS/3470/2009, de 16 de diciembre, por la que se publican las directrices sobre estudios posautorización de tipo observacional para medicamentos de uso humano [http://www.boe.es/boe/dias/2009/12/25/pdfs/BOE-A-2009-20817.pdf]
18. Recerca clínica amb medicaments. Departament de Salut. Generalitat de Catalunya. [http://www.gencat.cat/salut/depsalut/html/ca/dir2162/index.html]
19. Emanuel EJ, Wendler D, Grady C. What makes clinical research ethical?. JAMA. 2000; 283 (20): 2701-2711 (MEDLINE).
20. Weijer C. The ethical analysis of risk. J Law Med Ethics. 2000; 28(4): 344-261 (MEDLINE)
21. Sugarman J, Kass NE, Goodman SN, Perentesis P, Fernandes P, Faden RR. What patients say about medical research. IRB. 1998; 20(4) :1-7 (MEDLINE)
22. Jenkins V, Fallowfield L. Reasons for accepting or declining to participate in randomized clinical trials for cancer therapy. Br J Cancer. 2000; 82(11): 1783–1788 (ARTICULO)
23. Chalmers I. Lessons for research ethics committees. Lancet. 2002; 359 (9301): 174 (MEDLINE)
24. Mann H. Research ethics committees and public dissemination of clinical trial results. Lancet. 2002; 360 (9330): 406-408 (MEDLINE)
25. Savitz DA. Failure to publish results of epidemiologic studies is unethical. Epidemiology. 2000; 11 (3): 361-363 (MEDLINE)
26. Public
disseminations of trial results. A Standard for the Scientific and Ethical
Review of Trials
[http://www.assert-statement.org/publication.html]
27. Smith R. What is publication?. A continuum. BMJ.1999;318:142 (RESUMEN)
28. Decullier E, Chapuis F. Oral presentation bias: a retrospective cohort study. J Epidemiol Community Health. 2007;61(3):190-193 (ARTICULO)
29. Sterne JAC, Egger M, Smith GD. Investigating and dealing with publication and other biases in meta-analysis. BMJ. 2001;323:101-105 (ARTICULO)
30. Dundar Y, Dodd S, Dickson R, Walley T, Haycox A, Williamson PR. Comparison of conference abstracts and presentations with full-text articles in the health technology assessments of rapidly evolving technologies. Health Technol Assess. 2006;10(5):iii-iv, ix-145 (MEDLINE)
31. Chokkalingam A, Scherer R, Dickersin K. Concordance of data between conference abstracts and full reports [abstract]. Sixth International Cochrane Colloquium; 1998 Oct 22-26; Baltimore, MD, USA. Pag. 66 (RESUMEN)
32. Booth CM, Le Maître A, Ding K, Farn K, Fralick M, Phillips C, Cescon DW, Meyer RM. Presentation of Nonfinal Results of Randomized Controlled Trials at Major Oncology Meetings. J Clin Oncol. 2009;27(24):3938-3944 (ARTICULO)
33. Klassen TP, Wiebe N, Russell K, Stevens K, Hartling L, Craig WR, Moher D. Abstracts of randomized controlled trials presented at the society for pediatric research meeting: an example of publication bias. Arch Pediatr Adolesc Med. 2002;156(5):474-479 (MEDLINE)
34. Toma M, McAlister FA, Bialy L, Adams D, Vandermeer B, Armstrong PW. Transition from meeting abstract to full-length journal article for randomized controlled trials. JAMA. 2006;295(11):1281-1287 (MEDLINE)
35. Chalmers I, Adams M, Dickersin K, Hetherington J, Tarnow-Mordi W, Meinert C, Tonascia S, Chalmers TC. A cohort study of summary reports of controlled trials. JAMA. 1990;263(10):1401-1405. (MEDLINE)
36. Castillo J, Garcia-Guasch R, Cifuentes I. Fate of abstracts from the Paris 1995 European Society of Anaesthesiologists meeting. Eur J Anaesthesiol. 2002;19(12):888-893 (MEDLINE)
37. Simes RJ. Publication bias: the case for an international registry of clinical trials. J Clin Oncol. 1986;4(10):1529-1541 (MEDLINE)
38. Sim I, Olasov B, Carini S. The Trial Bank System: Capturing Randomized Trials for Evidence-Based Medicine. AMIA Annu Symp Proc. 2003; 2003: 1076 (MEDLINE)
39. Clarke MJ, Stewart LA. Meta-analyses using individual patient data. J Eval Clin Pract. 1997;3(3):207-212 (MEDLINE)
40. Clarke MJ, Stewart LA. Systematic reviews of randomized controlled trials: the need for complete data. J Eval Clin Pract. 1995;1(2):119-126 (MEDLINE)
41. Simmonds MC, Higgins JP, Stewart LA, Tierney JF, Clarke MJ, Thompson SG. Meta-analysis of individual patient data from randomized trials: a review of methods used in practice. Clin Trials. 2005;2(3):209-217 (MEDLINE)
42. Reidpath DD, Allotey PA. Data sharing in medical research: an empirical investigation. Bioethics. 2001;15(2):125-134 (MEDLINE)
43. Blumenthal D, Campbell EG, Anderson MS, Causino N, Louis KS. Withholding research results in academic life science. Evidence from a national survey of faculty. JAMA. 1997;277(15):1224-1228 (MEDLINE)
44. The Grey Literature Report, The New York Academy of Medicine [http://www.nyam.org/library/online-resources/grey-literature-report/]
45. GreyNet International. Grey Literature Network Service [http://www.greynet.org/]
46. OpenSIGLE. System for Information on Grey Literature in Europe [http://opensigle.inist.fr/]
47. Hopewell S, McDonald S, Clarke M, Egger M. Grey literature in meta-analyses of randomized trials of health care interventions. Cochrane Database Syst Rev. 2007 Apr 18;(2):MR000010 (MEDLINE)
48. Song F, Parekh S, Hooper L, Loke YK, Ryder J, Sutton AJ, et al. Dissemination and publication of research findings : an updated review of related biases. Health Technol Assess. 2010;14(8). (ARTICULO).
49. Ioannidis JPA. Contradicted and Initially Stronger Effects in Highly Cited Clinical Research. JAMA. 2005;294(2):218-228 (ARTICULO)
50. Chalmers TC, Frank CS, Reitman D. Minimizing the three stages of publication bias. JAMA. 1990;263(10):1392-1395 (MEDLINE)
51. Suñe-Martin P, Montoro-Ronsano JB. Role of a research ethics committee in follow-up and publication of results. Lancet. 2003;361(9376):2245-2246 (MEDLINE)
52. Pich J, Carné X, Arnaiz JA, Gómez B, Trilla A, Rodés J. Role of a research ethics committee in follow-up and publication of results. Lancet. 2003;361(9362):1015-1016 (MEDLINE)
53. Monzó Gruart M, Pla Poblador R. Seguimiento de los ensayos clinicos finalizados y sus posteriores publicaciones. Farmacia Hospitalaria. 2000;24(especial):107-108 (RESUMEN)
54. Decullier E, Lhéritier V, Chapuis F. Fate of biomedical research protocols and publication bias in France: retrospective cohort study. BMJ, 2005; 331:19 doi:10.1136/bmj.38488.385995.8F (ARTICULO)
55. Hall R, de Antueno C, Webber A; Canadian Research Ethics Board. Publication bias in the medical literature: a review by a Canadian Research Ethics Board. Can J Anaesth. 2007;54(5):380-388 (MEDLINE)
56. Blümle A, Antes G, Schumacher M, Just H, von Elm E. Clinical research projects at a German medical faculty: follow-up from ethical approval to publication and citation by others. J Med Ethics. 2008;34(9):e20 (MEDLINE)
57. Menzel S, Uebing B, Hucklenbroich P, Schober O. Evaluation of clinical trials following an approval from a research ethics committee. Dtsch Med Wochenschr. 2007;132(44):2313-2317 (MEDLINE)
58. Easterbrook PJ, Berlin JA, Gopalan R, Matthews DR. Publication bias in clinical research. Lancet. 1991;337(8746):867-872 (MEDLINE)
59. von Elm E, Röllin A, Blümle A, Huwiler K, Witschi M, Egger M. Publication and non-publication of clinical trials: longitudinal study of applications submitted to a research ethics committee. Swiss Med Wkly. 2008;138(13-14):197-203. (MEDLINE)
60. Dickersin K, Min YI, Meinert CL. Factors Influencing Publication of Research Results. Follow-up of Applications Submitted to Two Institutional Review Boards. JAMA. 1992;267(3):374-378 (ARTICULO)
61. Espona M, Vila Bundó A, Gómez-Ulloa D, Fernández Morató J, Urbina O, Berenguer N. Calidad en investigación de los ensayos clínicos: analisis de su publicación y consecución de objetivos. Comunicación oral 229. 54 Congreso de la Sociedad Española de Farmacia Hospitalaria. 22-25 de septiembre de 2009. Palacio de Congresos Expoaragón. Zaragoza (RESUMEN)
62. Dickersin K, Min YI. NIH clinical trials and publication bias. Online J Curr Clin Trials. 1993 Apr 28;Doc No 50 (MEDLINE)
63. Stern JM, Simes RJ. Publication bias: evidence of delayed publication in a cohort study of clinical research projects. BMJ. 1997;315:640 (ARTICULO)
64. Ioannidis JPA. Effect of the Statistical Significance of Results on the Time to Completion and Publication of Randomized Efficacy Trials. JAMA. 1998;279(4):281-286 (ARTICULO)
65. Hopewell S, Clarke M, Stewart L, Tierney J. Time to publication for results of clinical trials. Cochrane Database Syst Rev. 2007 Apr 18;(2):MR000011 (MEDLINE)
66. Hopewell S, Loudon K, Clarke MJ, Oxman AD, Dickersin K. Publication bias in clinical trials due to statistical significance or direction of trial results. Cochrane Database Syst Rev. 2009 Jan 21;(1):MR000006 (MEDLINE).
67. Misakian AL,Bero LA. Publication Bias and Research on Passive Smoking. Comparison of Published and Unpublished Studies. JAMA. 1998;280(3):250-253 (ARTICULO)
68. Cronin E, Sheldon T. Factors influencing the publication of health research. Int J Technol Assess Health Care. 2004 Summer;20(3):351-355 (MEDLINE)
69. Callaham ML, Weber E, Young G, Wears R, Barton C. Time to publication of studies was not affected by whether results were positive. BMJ. 1998;316:1536 (RESUMEN)
70. Cheng K, Preston C, Ashby D, O'Hea U, Smyth RL. Time to publication as full reports of abstracts of randomized controlled trials in cystic fibrosis. Pediatr Pulmonol. 1998;26(2):101-105 (MEDLINE)
71. Eloubeidi MA, Wade SB, Provenzale D. Factors associated with acceptance and full publication of GI endoscopic research originally published in abstract form. Gastrointest Endosc. 2001;53(3):275-282 (MEDLINE)
72. Evers JL. Publication bias in reproductive research. Hum Reprod. 2000;15(10):2063-2066 (MEDLINE)
73. Klassen TP, Wiebe N, Russell K, Stevens K, Hartling L, Craig WR, Moher D. Abstracts of randomized controlled trials presented at the society for pediatric research meeting: an example of publication bias. Arch Pediatr Adolesc Med. 2002;156(5):474-479 (MEDLINE)
74. Krzyzanowska MK, Pintilie M, Tannock IF. Factors Associated With Failure to Publish Large Randomized Trials Presented at an Oncology Meeting. JAMA. 2003;290(4):495-501(ARTICULO)
75. Dickersin K, Olson CM, Rennie D, Cook D, Flanagin A, Zhu Q, Reiling J, Pace B. Association Between Time Interval to Publication and Statistical Significance. JAMA. 2002;287(21):2829-2831 (ARTICULO)
76. Begg CB, Berlin JA. Publication bias and dissemination of clinical research. J Natl Cancer Inst. 1989;81(2):107-115 (MEDLINE)
77. Dickersin K. The existence of publication bias and risk factors for its occurrence. JAMA. 1990 Mar 9;263(10):1385-9. (MEDLINE)
78. De Angelis C, Drazen JM, Frizelle FA, Haug C, Hoey J, Horton R, Kotzin S, Laine C, Marusic A, Overbeke JPM, Schroeder TV, Sox HC, Van Der Weyden MB. Clinical Trial Registration: A Statement from the International Committee of Medical Journal Editors. N Engl J Med 2004; 351:1250-1251 (ARTICULO)
79. International Committee of Medical Journal Editors. [http://www.icmje.org/]
80. McCormack JP, Loewen PS, Jewesson PJ. Publication bias, selective dissemination and trial registries. BMJ, Published 15 july 2005. (CARTA)
81. http://clinicaltrials.gov/
82. https://eudract.emea.europa.eu/
83. http://www.gsk-clinicalstudyregister.com/
84. http://novonordisk-trials.com/
85. http://www.roche-trials.com/
86. http://www.astrazenecaclinicaltrials.com/
87. CONSORT – Consolidated standards of reporting trials [http://www.consort-statement.org/]
88. STARD - Standards for the reporting of diagnostic accuracy studies [http://www.stard-statement.org/]
89. STROBE – Strengthening the reporting of observational studies in epidemiology [http://www.strobe-statement.org/]
90. PRISMA – Preferred reporting items for systematic reviews and meta-analyses [http://www.prisma-statement.org/]
91. EQUATOR network – Enhancing the Quality and Transparency of Health Research [http://www.equator-network.org/]
92. Committee on Publication Ethics (COPE) [http://publicationethics.org/]
93. Gottlieb S. Firm tried to block report on failure of AIDS vaccine. BMJ. 2000;321:1173 doi: 10.1136/bmj.321.7270.1173 (RESUMEN)
94. Spurgeon D. Trials sponsored by drug companies: review ordered. BMJ. 1998;317:618 (RESUMEN)
95. Wise J. Research suppressed for seven years by drug company. BMJ. 1997;314:1145. (RESUMEN)
96. Chalmers I. Underreporting Research Is Scientific Misconduct. JAMA. 1990;263(10):1405-1408. (RESUMEN)