Mecanismos moleculares de la homeostasis endolisosomal y vesículas extracelulares. IP: Albert Lu Lopez
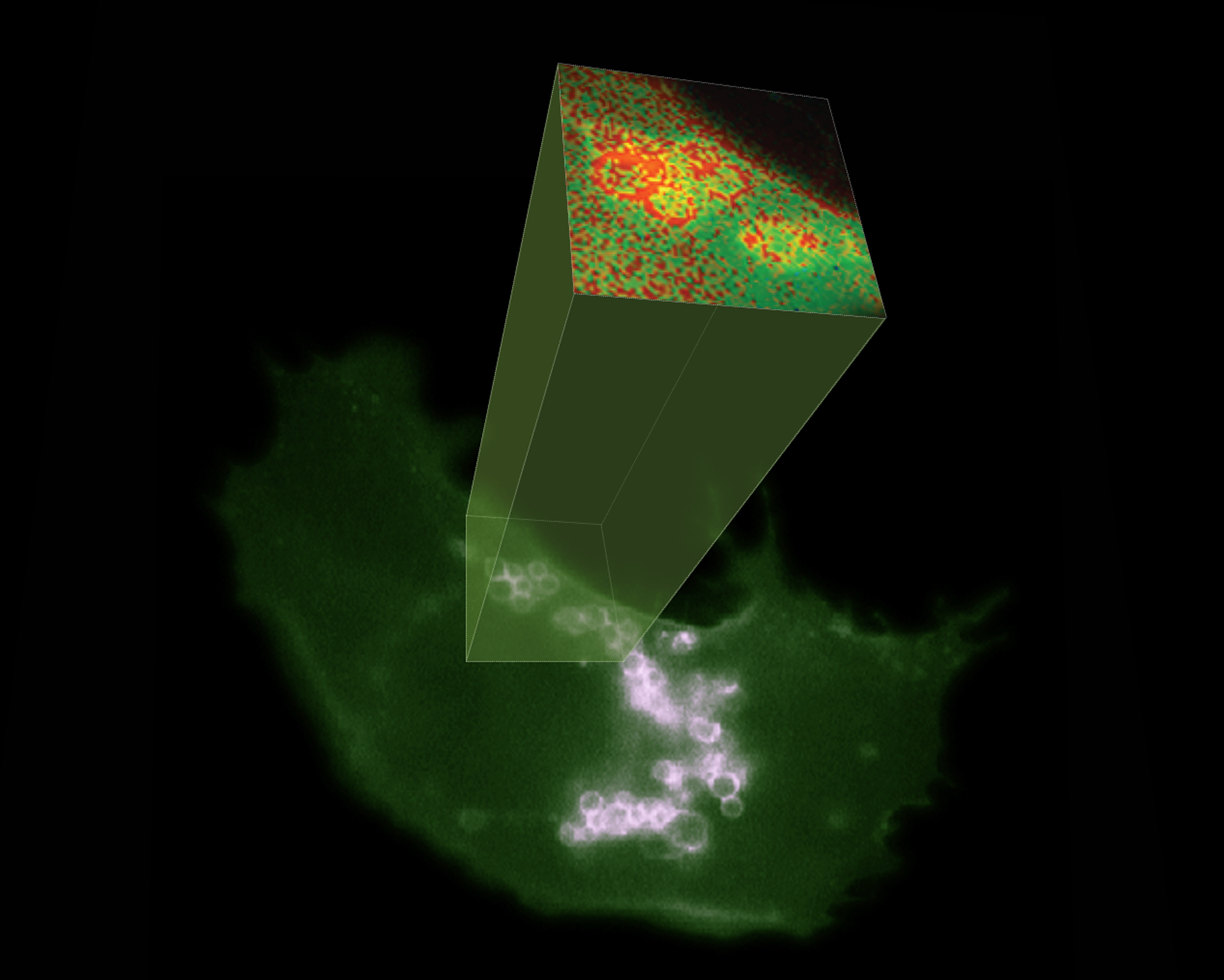
El compartimento endolisosomal juega un papel central en la regulación metabólica y de señalización en las células. Además, este compartimento es la localización celular donde se generan los exosomas, los cuales son liberados a nivel extracelular tras la exocitosis endolisosomal.
Nuestro grupo de investigación busca comprender los mecanismos moleculares que regulan diferentes aspectos de la homeostasis endolisosomal y la biología de las vesículas extracelulares (EVs), incluyendo los exosomas. Anteriormente hemos desarrollado screenings genéticos basados en la tecnología CRISPR/Cas9 para identificar genes implicados en la regulación de la biología subyacente de las EVs y el transporte de lípidos endolisosomales. Nuestro laboratorio utiliza ensayos bioquímicos, técnicas de biología celular y genética molecular, incluyendo metodologías de genómica funcional, para investigar las vías transporte y reclutamiento de carga exosomal, así como el tráfico de lípidos desde los endolisosomas en diferentes contextos patológicos.
PALABRAS CLAVE: Endolisosomas, Exosomas, Vesículas extracelulares, comunicación mediada por EVs, señalización de KRas, colesterol, tráfico intracelular de membranas.

Albert Lu Lopez
Professor lector
albertlu@ub.edu

Moisés Castellà Giner
Investigador Postoctoral
moises.castella@ub.edu

Marta Esplugas Miravent
Estudiant de grau
martaesplum@gmail.com

Elsa Meneses-Salas
Investigadora Postoctoral
elsameneses@ub.edu

Pol Sauqué i Martínez
Estudiant de doctorat
psauquma7@alumnes.ub.edu
Esclarecer los mecanismos moleculares del sorting de microRNAs en exosomas de células de cáncer de colon.
Investigación del papel de SNX13 en el transporte endolisosomal de colesterol en el contexto de la enfermedad de Niemann-Pick tipo C.
Disección molecular de la liberación de bis(monocilglicero)fosfato mediada por exosomas en la enfermedad de Parkinson asociada a LRRK2.
Role of KRAS and its phosphorylation in the epithelial organization, invasion and biogenesis of exosomes from colorectal cancer cells (PID2022-138728OB-I00)
Agencia de financiación: Ministerio de Ciencia e Innovación (España)
Periodo: 01/09/2023-31/08/2026
IP: Albert Lu (IP2, UB) i Neus Agell (IP1, UB)
LRRK2 kinase and glucocerebrosidase (GCase) activity-mediated regulation of a lysosomal phospholipid, bis(monoacylglycerol)-phosphate (BMP)
Agencia de financiación: The Michael J. Fox Foundation for Parkinson’s Research
Periodo: 01/12/2023-30/11/2025
IP: Albert Lu (UB)
Role of SNX13 in an NPC1 bypass cholesterol egress pathway
Agencia de financiación: Ara Parseghian Medical Research Fund
Periodo: 01/07/2023-30/06/2024
IP: Albert Lu (UB)
LRRK2 kinase and glucocerebrosidase (GCase) activity-mediated regulation of a lysosomal phospholipid, bis(monoacylglycerol)-phosphate (BMP)
Agencia de financiación: The Michael J. Fox Foundation for Parkinson’s Research
Periodo: 01/04/2021-31/03/23
IP: Albert Lu (IP2, UB) y Dr.Kalpana Merchant (IP1, Northwestern University, US)
2021 SGR 00284 Cell Compartments:trafficking and signaling in health and disease
Agencia de financiación: Generalitat de Catalunya
Periodo:01/01/2022- 31/12/2024
IP: N. Agell; Research collaborator: Albert Lu; Concedido UB
Importe: 60.000 €
Para más información sobre las publicaciones del IP del grupo pueden visitar el siguiente enlace:
Meneses-Salas, E., Arnold M., Hsieh, F., Enrich, C., Pfeffer, S.R., Merchant, K. and Lu, A*. Exosome-mediated release of bis(monoacylglycerol)phosphate is regulated by LRRK2 and Glucocerebrosidase activity. bioRxiv 2023.07.12 .548710; doi: 10.1101/ 2023.07.12.548710. *corresponding author.
Lu A. Quantitative Analysis of Extracellular Vesicle Release Using Artificial MicroRNAs. Methods Mol Biol. 2023:2668: 191-207. doi: 10.1007/ 978-1-0716-3203-1_14. PMID: 37140798
Enrich C, Lu A, Tebar F, Rentero C, Grewal T. Ca2+ and Annexins - Emerging Players for Sensing and Transferring Cholesterol and Phosphoinositides via Membrane Contact Sites. Adv Exp Med Biol. 2023:1422: 393-438. doi: 10.1007/ 978-3-031-21547-6_15. PMID: 36988890
Lu A. Endolysosomal cholesterol export: More than just NPC1. Bioessays. 2022 Oct; 44(10):e2200111. doi: 10.1002/ bies.202200111. Epub 2022 Aug 7. PMID: 35934896
Enrich C, Lu A, Tebar F, Rentero C, Grewal T. Annexins Bridging the Gap: Novel Roles in Membrane Contact Site Formation. Front Cell Dev Biol. 2022 Jan 6:9: 797949. doi: 10.3389/ fcell.2021.797949. eCollection 2021. PMID: 35071237
Lu A*, Hsieh F, Sharma BR, Vaughn SR, Enrich C, Pfeffer SR. CRISPR screens for lipid regulators reveal a role for ER-bound SNX13 in lysosomal cholesterol export. J Cell Biol. 2022 Feb 7;221(2): e202105060. doi: 10.1083/ jcb.202105060. Epub 2021 Dec 22. *corresponding author. PMID: 34936700
Jose J, Hoque M, Engel J, Beevi SS, Wahba M, Georgieva MI, Murphy KJ, Hughes WE, Cochran BJ, Lu A, Tebar F, Hoy AJ, Timpson P, Rye KA, Enrich C, Rentero C, Grewal T. Annexin A6 and NPC1 regulate LDL-inducible cell migration and distribution of focal adhesions. Sci Rep. 2022 Jan 12; 12(1): 596. doi: 10.1038/ s41598-021-04584-y. PMID: 35022465
Saha P, Shumate JL, Caldwell JG, Elghobashi-Meinhardt N, Lu A, Zhang L, Olsson NE, Elias JE, Pfeffer SR. Inter-domain dynamics drive cholesterol transport by NPC1 and NPC1L1 proteins. Elife. 2020 May 15:9: e57089. doi: 10.7554/ eLife.57089. PMID: 32410728
Kumar S, Barouch-Bentov R, Xiao F, Schor S, Pu S, Biquand E, Lu A, Lindenbach BD, Jacob Y, Demeret C, Einav S. MARCH8 Ubiquitinates the Hepatitis C Virus Nonstructural 2 Protein and Mediates Viral Envelopment. Cell Rep. 2019 Feb 12;26(7): 1800-1814.e5. doi: 10.1016/ j.celrep.2019.01.075. PMID: 30759391
Lu A*, Wawro P, Morgens DW, Portela F, Bassik MC, Pfeffer SR. Genome-wide interrogation of extracellular vesicle biology using barcoded miRNAs. Elife. 2018 Dec 17:7: e41460. doi: 10.7554/ eLife.41460. PMID: 30556811
Barouch-Bentov R, Neveu G, Xiao F, Beer M, Bekerman E, Schor S, Campbell J, Boonyaratanakornkit J, Lindenbach B, Lu A, Jacob Y, Einav S. Hepatitis C Virus Proteins Interact with the Endosomal Sorting Complex Required for Transport (ESCRT) Machinery via Ubiquitination To Facilitate Viral Envelopment. mBio. 2016 Nov 1;7(6): e01456-16. doi: 10.1128/ mBio.01456-16. PMID: 27803188
Lu A*, Pfeffer SR. A CULLINary ride across the secretory pathway: more than just secretion. Trends Cell Biol. 2014 Jul;24(7):389-99. doi: 10.1016/j.tcb.2014.02.001. *corresponding author. PMID: 24630736
Gelabert-Baldrich M, Soriano-Castell D, Calvo M, Lu A, Viña-Vilaseca A, Rentero C, Pol A, Grinstein S, Enrich C, Tebar F. Dynamics of KRas on endosomes: involvement of acidic phospholipids in its association. FASEB J. (2014) 28(7): 3023-37. doi: 10.1096/ fj.13-241158. PMID: 24719356
Lu A*, Pfeffer SR. Golgi-associated RhoBTB3 targets cyclin E for ubiquitylation and promotes cell cycle progression. J Cell Biol. 2013 Oct 28;203(2): 233-50. doi: 10.1083/ jcb.201305158. Epub 2013 Oct 21. PMID: 24145166
Lu A, Tebar F, Alvarez-Moya B, López-Alcalá C, Calvo M, Enrich C, Agell N, Nakamura T, Matsuda M, Bachs O. A clathrin-dependent pathway leads to KRas signaling on late endosomes en route to lysosomes. J Cell Biol. 2009 Mar 23;184(6): 863-79. doi: 10.1083/ jcb.200807186. Epub 2009 Mar 16. PMID: 19289794
- Ofertas de la Universidad de Barcelona:
- Ofertas del grupo de investigación:
Por el momento, no hay ofertas de trabajo de este grupo de investigación
