Biología molecular de la enfermedad de Huntington. IP: Verónica Inés Brito
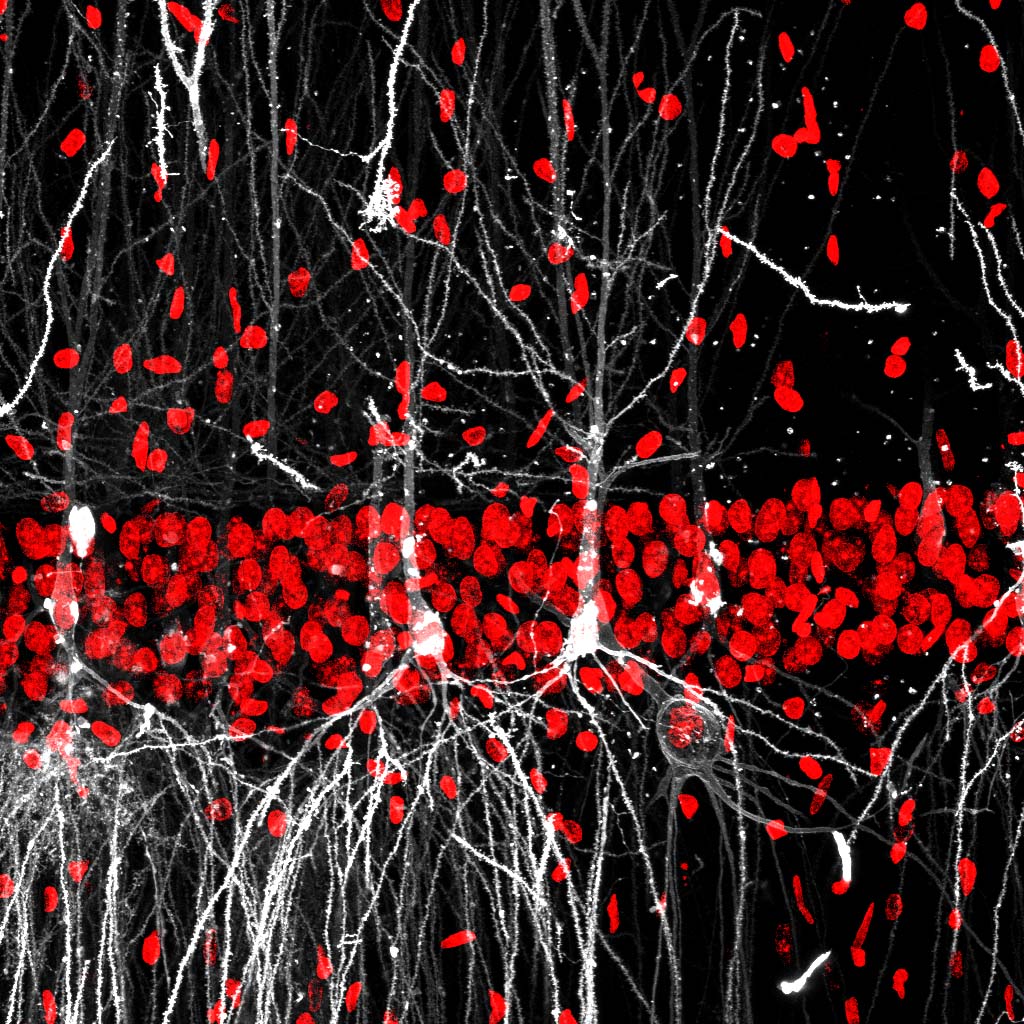
Nuestro grupo está interesado en estudiar un novedoso nivel de regulación de la expresión génica que está mediado por modificaciones postranscripcionales del ARN conocido como Epitranscriptómica. Estas marcas químicas o modificaciones del ARN, son dinámicas, pueden ser muy abundantes en el cerebro y estar implicadas en diferentes procesos neuronales regulando la función del ARN neuronal.
Nuestro principal objetivo es explorar y caracterizar el papel de estas modificaciones y los factores regulatorios de la maquinaria epitranscriptómica en el inicio y progresión de enfermedades neurodegenerativas, particularmente, de la patología de la enfermedad de Huntington (EH). Para ello hemos desarrollado una estrategia interdisciplinaria que combina técnicas de transcriptómica, métodos bioquímicos, inmunohistoquímica y estudios funcionales en ratones modelos de la enfermedad.
PALABRAS CLAVE: Enfermedad de Huntington, modificaciones del ARN, reparación del ADN, actividad neuronal, epigenética, Huntingtina, empalme alternativo, edición de genes CRISPR, disfunción sináptica

Verónica Inés Brito
Investigador principal (Lector Serra Hunter)
veronica.brito@ub.edu

Maria Bergé Gardeñes
Estudiante de master en Bioquímica, Biología Molecular y Biomedicina
mariaberge01@gmail.com

Carla Castells Esteve
Asistente de investigación
carla.castells@ub.edu
ANTIGUOS MIEMBROS:

Anika Pupak
Estudiante de doctorado
(2019-2022)
Irene Rodríguez Navarro
Investigadora pre-doctoral
(2022-2023)
- Identificación de los cambios epitranscriptómicos asociados a la desregulación transcripcional, la disfunción sináptica y los déficits cognitivos y motores de la EH.
- Análisis y estudio del papel de las modificaciones epigenéticas del ARN en la generación de fragmentos tóxicos de la huntingtina mutada.
- Dissecting the role of m6A as epigenetic guardian of somatic instability in Huntington´s disease
Ministerio de Ciencia, Innovación y Universidades
Programa consolidación investigadora. CNS2023-144738.
IP: Veronica Brito
Subvención: 175.000 €
2024-2026
- A pilot study of a novel molecular assay to quantify DNA repair synthesis in the HTT exon 1 as readout of somatic instability in Huntington´s Disease
European Huntington´s Disease Network
EHDN Seed fund 1296
IP: Veronica Brito
Subvención: 50.000 €
2024-2025
- Deciphering the role of m6A RNA methylation as a new layer of gene expression regulation in Huntington´s disease pathology (MetHD)
PID2020-116474RB-I00
Ministerio de Ciencia, Innovación y Universidades
IP: Veronica Brito
Subvención: 140.000 €
2021-2024
- Exploring m6A modifications as critical modulators of mutant huntingtin alternative splicing
Hereditary Disease Foundation (HDF)
IP: Veronica Brito
Subvención: 63.000 €
2021-2022
- Study of mitochondrial outcomes as biomarkers of Huntington´s Disease progression and/or readouts of pharmacological interventions
Huntington´s Disease Society of America (HDSA) Human Biology Program
IP: Veronica Brito
Subvención: 63.000 €
2017-2018
Para más información sobre las publicaciones del IP del grupo puede visitar los siguientes enlaces:
ORCID: 0000-0002-4137-0708
Scopus Author ID: 6701599747
Researcher ID: M-2112-2015
Loop Profile: 776206
Rodríguez-Urgellés E, Casas-Torremocha D, Sancho-Balsells A, Ballasch I, García-García E, Miquel-Rio L, Manasanch A, Del Castillo I, Chen W, Pupak A, Brito V, Tornero D, Rodríguez MJ, Bortolozzi A, Sanchez-Vives MV, Giralt A, Alberch J. Thalamic Foxp2 regulates output connectivity and sensory-motor impairments in a model of Huntington's Disease. Cell Mol Life Sci. 2023 Nov 21;80(12):367. doi: 10.1007/ s00018-023- 05015-z. PMID: 37987826
Espina M, Di Franco N, Brañas-Navarro M, Navarro IR, Brito V, Lopez-Molina L, Costas-Insua C, Guzmán M, Ginés S (2023) The GRP78-PERK axis contributes to memory and synaptic impairments in Huntington's disease R6/1 mice. Neurobiol Dis. 2023 Aug:184:106225. doi: 10.1016/ j.nbd.2023.106225. Epub 2023 Jul 11. PMID: 37442396
Pupak A, Rodríguez Navarro I, Sathasivam K, Essmann E, Singh A, del Toro D, Ginés S, Bates GP, Vang Ørom U, Marti E, Brito V. m6A RNA modification of mHtt intron 1 regulates the generation of Htt1a in Huntington’s Disease. Preprint bioRxiv (2023) doi: https://doi.org/10.1101/2023.11.10.566530
Sancho-Balsells A, Borràs-Pernas S, Brito V, Alberch J, Girault JA, Giralt A. Cognitive and Emotional Symptoms Induced by Chronic Stress Are Regulated by EGR1 in a Subpopulation of Hippocampal Pyramidal Neurons. Int J Mol Sci. 2023 Feb 14;24(4): 3833. doi: 10.3390/ ijms24043833 doi: 10.3390/ijms24043833. PMID: 36835243
Garcia-Forn M, Castany-Pladevall C, Golbano A, Pérez-Pérez J, Brito V, Kulisevsky J, Pérez-Navarro E. Lamin B1 and nuclear morphology in peripheral cells as new potential biomarkers to follow treatment response in Huntington's disease. Clin Transl Med. 2023 Feb;13(2): e1154. doi: 10.1002/ ctm2.1154. PMID: 36781300
Rodríguez-Urgellés E, Rodríguez-Navarro I, Ballasch I, Del Toro D, Del Castillo I, Brito V, Alberch J, Giralt A. Postnatal Foxp2 regulates early psychiatric-like phenotypes and associated molecular alterations in the R6/1 transgenic mouse model of Huntington's disease. Neurobiol Dis. 2022 Oct 15:173:105854. doi: 10.1016/ j.nbd.2022.105854. Epub 2022 Aug 24. PMID: 36029989
Pupak A., Singh A, Sancho A, Espina M, Giralt A, Marti, E Vang Orom, U, Gines S, Brito V. Altered m6A RNA methylation contributes to hippocampal memory deficits in Huntington´s disease mice. Cell Mol Life Sci. 2022 Jul 11; 79(8):416. doi: 10.1007/ s00018-022-04444-6. PMID: 35819730
Brito V*, Montalban E, Pupak A, Masana M, Ginés S, Alberch J, Martin C, Girault JA, Giralt A*. Hippocampal Egr1-dependent neuronal ensembles negatively regulate motor learning. J. Neurosci. 2022 Jul 6;42(27): 5346-5360. doi: 10.1523/ JNEUROSCI. 2258-21.2022. Epub 2022 May 24. * co-correspondings. PMID: 35610044
Matute-Blanch C, Brito V, Midaglia L, Villar LM, Garcia-Diaz Barriga G, Guzman de la Fuente A, Borrás E, Fernández-García S, Calvo-Barreiro L, Miguez A, Costa-Frossard L, Pinteac R, Sabidó E, Alberch J, Fitzgerald DC, Montalban X, Comabella M. Inflammation in multiple sclerosis induces a specific reactive astrocyte state driving non-cell-autonomous neuronal damage.Clin Transl Med. 2022 May;12(5):e837. doi: 10.1002/ ctm2.837. PMID: 35538884
García-Serra S, Radosevic M, Pupak A, Brito V, Ríos J, Aguilar E, Maudes E, Ariño H, Spatola M, Mannara F, Pedreno M, Joubert B, Ginés S, Planagumà P, and Dalmau J. Placental transfer of NMDAR antibodies causes reversible alterations in mice. Neurology, Neuroimmunol & Neuroinflam. 2021 Jan; 8(1): e915. Published online 2020 Nov 10. doi: 10.1212/ NXI.0000000000000915. PMC7713722
Sancho-Balsells A, Brito V, Fernández B, Pardo M, Straccia M, Ginés S, Alberch J, Hernández I, Arranz B, Canals JM, Giralt A. A Lack of Helios During Neural Development Induces Adult Schizophrenia-Like Behaviors Associated With Aberrant Levels of the TRIF-Recruiter Protein WDFY1. Front Cell Neurosci. doi: 10.3389/ fncel.2020.00093. eCollection 2020 (IF: 3,921) PMID: 32477064
Giralt A, Brito V, Pardo M, Rubio SE, Marion-Poll L, Martín-Ibáñez R, Zamora-Moratalla A, Bosch C, Ballesteros JJ, Blasco E, García-Torralba A, Pascual M, Pumarola M, Alberch J, Ginés S, Martín ED, Segovia J, Soriano E, Canals JM. Helios modulates the maturation of a CA1 neuronal subpopulation required for spatial memory formation. Exp Neurol. 2020 Jan;323:113095. doi: 10.1016/j.expneurol.2019. 113095 (IF:4.562)
Comella Bolla A, Valente T, Miguez A, Brito V, Gines S, Solà C, Straccia M, Canals JM. CD200 is up-regulated in R6/1 transgenic mouse model of Huntington's disease. PLoS One. 2019 Dec 2;14(12):e0224901. doi: 10.1371/ journal.pone. 0224901 (IF: 2,776) PMID: 31790427
Brito V, Giralt A, Castañé A, Massana M, Alberch J and Ginés S. Cdk5 dysfunction contributes to depressive-like behaviors in Huntington´s Disease by altering the phospho-DARPP-32 status in the nucleus accumbens. Biol Psychiatry. 2019 Aug 1;86(3): 196-207. doi: 10.1016/ j.biopsych. 2019.03.001 (IF: 11,982) PMID: 31060804
Montalban E, Al-Massadi O, Sancho-Balsells A, Brito V, de Pins B, Alberch J, Ginés S, Girault JA, Giralt A. Pyk2 in the amygdala modulates chronic stress sequelae via PSD-95-related micro-structural changes. Transl Psychiatry. Jan 15; 9(1):3. 2019 (IF: 4.691) PMID: 30664624
Suelves Nuria; Miguez Andres; Lopez-Benito Saray; García-Díaz Barriga Gerardo; Giralt Albert; Alvarez-Periel Elena; Arevalo Juan Carlos; Alberch Jordi; Gines Silvia; Brito Veronica. Early downregulation of p75NTR by genetic and pharmacological approaches delays the onset of motor deficits and striatal dysfunction in Huntington´s disease mice. Molecular neurobiology. DOI: 10.1007/ s12035-018-1126-5. 2019 (IF: 5,076) PMID: 29804232
Alvarez-Periel E, Puigdellívol M, Brito V, Plattner F, Bibb JA, Alberch J, Ginés S. Cdk5 Contributes to Huntington's Disease Learning and Memory Deficits via Modulation of Brain Region-Specific Substrates. Mol Neurobiol. Aug;55(8): 6250-6268. doi: 10.1007/ s12035-017-0828-4. 2018 (IF: 5,076) PMID: 29288339
López-Benito Saray; Sánchez-Sánchez Julia; Brito Veronica; Calvo Laura; Torres-Valle Maria; Palko Mary Ellen; Vicente-García Cristina; Fernandez-Fernandez Seila; Bolaños Juan; Gines Silvia; Tessarollo Lino; Lisa Silvia; Arevalo Juan Carlos. Regulation of BDNF release by ARMS/Kidins220 through modulation of Synaptotagmin-IV levels. Journal of Neuroscience. Jun 6;38(23):5415-5428. doi: 10.1523/JNEUROSCI.1653-17. 2018 (IF: 5.988) PMID: 29769266
Illa M, Brito V, Pla L, Eixarch E, Arbat-Plana A, Batallé D, Muñoz-Moreno E, Crispi F, Udina E, Figueras F, Ginés S, Gratacós E. Early Environmental Enrichment Enhances Abnormal Brain Connectivity in a Rabbit Model of Intrauterine Growth Restriction. Fetal Diagn Ther. 2018;44 (3):184-193. doi: 10.1159/000481171. 2018 (IF: 1,8) PMID: 29020672
Giralt A, Brito V, Chevy Q, Simonnet C, Otsu Y, Cifuentes-Díaz C, de Pins B, Coura R, Alberch J, Ginés S, Poncer JC, Girault JA. Pyk2 modulates hippocampal excitatory synapses and contributes to cognitive deficits in a Huntington's disease model. Nat Comm. May 2017. 30;8:15592. doi: 10.1038/ncomms15592. (IF: 12,124). PMID: 28555636
Brito V, Giralt A, Enriquez-Barreto L, Puigdellívol M, Suelves N, Zamora-Moratalla A, Ballesteros JJ, Martín ED, Dominguez-Iturza N, Morales M, Alberch J, Ginés S. Neurotrophin receptor p75NTR mediates Huntington's disease-associated synaptic and memory dysfunction. J Clin Invest 124(10):4411-28. doi: 10.1172/JCI74809. Epub 2014 Sep 2. (IF: 13,215). PMID: 25180603
Brito V, Gines S. p75NTR in Huntington's disease: beyond the basal ganglia. Oncotarget. 5;7(1):1-2. 2016. doi: 10.18632/ oncotarget.6646. (IF: 6,368) Editorial Letter. PMID: 26700963
Miguez A, García-Díaz Barriga G, Brito V, Straccia M, Giralt A, Ginés S, Canals JM, Alberch J. Hum Mol Genet. 1;24 (17):4958-70. 2015 (IF: 6,393)
Puigdellivol M, Cherubini M, Brito V, Giralt A, Suelves N, Zamora-Moratalla A, Martin E. Eipper B, Alberch J, Gines S. A role for Kalirin-7 in .corticostriatal synaptic dysfunction in Huntington’s disease. Hum Mol Genet Dec 20; 24(25): 7265-85. doi: 10.1093/ hmg/ddv426. Epub 2015 Oct 12. 2015 (IF: 6,393). PMID: 26464483
- Ofertas de la Universidad de Barcelona:
- Ofertas del grupo de investigación:
Por el momento, no hay ofertas de trabajo de este grupo de investigación