Autores:
Soler, A.; Domènech, C.; Otero, N.; Rosell, M.; Barbieri, M.
Grup de Mineralogia Aplicada i Geoquímica de Fluids
Dep. Cristal·lografia, Mineralogia i Dipòsits Minerals, Facultat de Geologia, Universitat de Barcelona
Los isótopos son átomos de un mismo elemento químico con igual número de protones pero distinto número de neutrones (Fig. 1). Los isótopos se clasifican en radioactivos, aquellos que se desintegran emitiendo radiaciones y tienen una vida media inferior a los 3000 millones de años, y estables, aquellos que tienen una vida media superior a los 3000 millones de años. Link 1 Conceptos básicos
La composición isotópica de isótopos estables se expresa mediante la relación isotópica (R) entre la abundancia del isótopo menos abundante y la del más abundante. Para los principales isótopos de elementos ligeros (H, C, N, O, S) se expresa con la desviación isotópica o delta (δ), que se obtiene según:
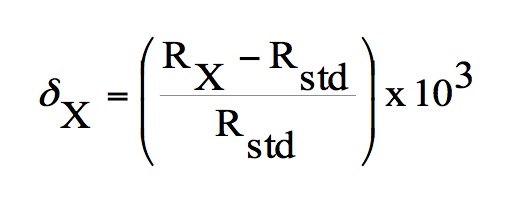
donde Rx es la relación entre la abundancia del isótopo pesado y del ligero en la sustancia problema y Rstd, la misma relación en una sustancia-patrón. La delta (δ) se representa en tanto por mil (‰). Link 1A Expresión de las abundancias
En el caso de los isótopos de elementos con número atómico elevado, por ejemplo el Sr, Pb, etc, la composición isotópica se expresa directamente por la relación entre la abundancia de ambos isótopos sin ponderar a ningún estándar (87Sr/86Sr). Y en el caso de los isótopos radioactivos su concentración se expresa con la medida de su radioactividad. Las unidades más frecuentes para medir la radioactividad son el Bequerelio (Bq) y el Curio (c). Debido a las bajas actividades que se miden en las aguas subterráneas se utilizan submúltiplos de estos. Un Bequerelio (Bq) corresponde a una desintegración en un segundo y un Curio (c) es el número de desintegraciones por segundo que tienen lugar en 1 gramo de 226Ra. Link 2 Nomenclatura isotópica
Las moléculas que contienen el isótopo ligero reaccionarán con una velocidad ligeramente superior a la de las moléculas pesadas. Este reparto de isótopos durante una determinada reacción se conoce como fraccionamiento isotópico, el cual corresponde a la distribución de los isótopos estables entre fases coexistentes, A y B,
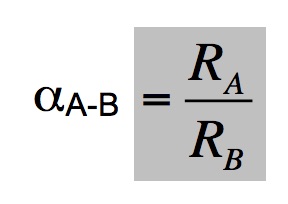
donde R es la relación entre la abundancia del isótopo ligero y la abundancia del pesado en la fase indicada por el subíndice. Dado que las propiedades químicas de un elemento son función básicamente de su configuración electrónica, todos los isótopos tendrán un comportamiento químico similar. Sin embargo las propiedades físicas, que dependen de la estructura y masa del núcleo variaran entre ellos. Link 3 Fraccionamiento
Las medidas isotópicas se realizan mediante un espectrómetro de masas de relaciones isotópicas que se conoce por sus siglas en inglés IRMS (Isotope Ratio Mass Spectrometer) que se caracteriza por no medir la concentración de un determinado isótopo, sino por comparar la relación isotópica de la muestra respecto a un patrón de relación conocida. Un IRMS consta de una entrada de muestras en forma gaseosa, de una fuente de ionización por impacto electrónico y de un sistema de colectores múltiples, todo ello con un campo de vuelo y un campo magnético que facilita la separación de los iones en función de su masa. Link 4 IRMS
El muestreo de aguas, suelos y gases es función de los análisis a determinar, si bien en todos los casos hay que recolectar las muestras de manera que no pueda sufrir procesos de evaporación, degradación o reacción entre el muestreo y su análisis. Por ello se mantendrán las muestras en frio (4ºC ) hasta el momento de su análisis. Link 5 Muestreo
Bibliografía
