Recursos de recerca i docència
Novetats
-
La capacitat d’inhibir la mitofàgia converteix a la fluorizolina en un prometedor agent antitumoral
Recerca liderada pel grup del Dr. Joan Gil
Notícia | Wed Oct 13 02:00:00 CEST 2021 -
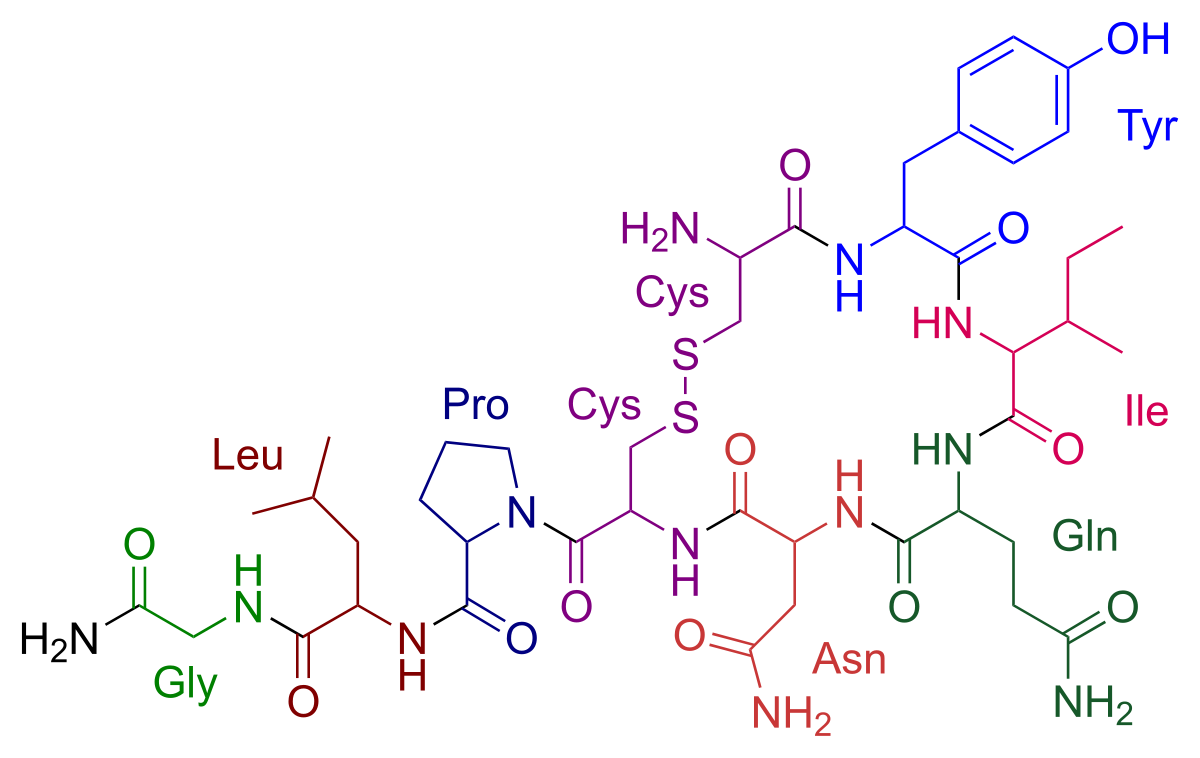
Un compost natural, designat medicament orfe pel tractament de la cistinuria
Notícia | Wed Sep 08 02:00:00 CEST 2021 -
Raul Estévez, nou catedràtic de Fisiologia del Departament
Notícia | Thu Mar 25 01:00:00 CET 2021