Per què la mesurem
La conductivitat és una mesura integrada de les substàncies de caràcter iònic (sals) presents a l'aigua. Es pot afirmar, doncs, que com més conductivitat té l'aigua més mineralitzada està, més sals conté.
Als rius sense alteració humana, la conductivitat depèn de la geologia de la conca a causa de la diferent solubilitat dels materials que conformen el sòl; per exemple, els rius amb conques de geologia més calcària presenten conductivitats més elevades que les de geologia silícia. També varia amb la distància a la capçalera del riu, a causa de la diferent variació de la superfície de la conca que ha sigut rentada. Així, als trams baixos dels rius la conductivitat és de manera natural més elevada que a les capçaleres.
|
|
| Conductímetre YSI model 63 |
La conductivitat és la mesura de la quantitat d'ions que hi ha a l'aigua, i es determina amb la concentració de sals dissoltes que conté. Els ions majoritaris a l'aigua dels rius són els clorurs, bicarbonats, sulfats, calci, magnesi, sodi i potassi. Els ions minoritaris serien els que es presenten en menys d'un 1% del total d'ions. Els més importants són els bromurs, iodurs, silici, liti, estronci, fosfats, nitrits, ferro, manganès, alumini, amoni, sulfurs i fluorurs. La magnitud de la conductivitat depèn, doncs, de la concentració i el grau de dissociació d'aquests ions, tot i que també hi influeix la temperatura i la velocitat de migració. Així doncs, és imprescindible que aquesta mesura sigui feta in situ.
Tot i això, el valor de la conductivitat també es veu influït per l'activitat humana. Als llocs més o menys humanitzats, hi està relacionada amb els usos del sòl o la presència d'abocaments d'aigües residuals, que aporten al riu clorurs i altres sals. És especialment notori l'increment de la conductivitat dels rius a les zones amb extraccions mineres de sal o amb l'ús industrial de productes descalcificadors, si no hi ha un bon tractament de les aigües residuals.
Les aigües per a usos agrícoles o de consum humà no poden tenir una conductivitat excessivament elevada. Es consideren els 1.000 µS/cm com el límit a partir del qual les aigües són difícils de potabilitzar per al consum humà. Per als organismes adaptats a viure en aigües continentals dolces, on les sals no haurien de superar l'1‰, les conductivitats elevades representen un risc de toxicitat pels problemes de regulació osmòtica que això comporta.
Com la mesurem
Per mesurar la conductivitat elèctrica de l'aigua als punts de mostreig, es disposa de conductímetres de mesura in situ (en el nostre cas és l'aparell multiparamètric YSI model 63), que permeten mesurar-la per als rangs d'aigües continentals en microsiemens per cm (µS/cm).
Com la representem
Les dades de conductivitat es representen als mapes de resultats en els tres rangs que es mostren a la taula següent, que diferencien tres tipus d'efectes sobre la fauna aquàtica.
| Símbol | Conductivitat (µS/cm) | Interpretació |
 |
< 100 |
Aigües poc mineralitzades. Aigua que amb tota seguretat no ha tingut abocaments importants. |
 |
100-1000 |
Aigües mitjanament mineralitzades. Es poden donar de forma natural en rius. |
 |
> 1000 |
Aigües molt mineralitzades, sovint afectades per abocaments d'aigües residuals, tot i que en algun cas pot ser deguda a la geologia de la zona. Aigua que es considera fora de molt difícil potabilització. |
Per què el mesurem
El pH ens dóna una idea del grau d'acidesa d'una massa d'aigua. Un pH massa baix (per sota de 6) o massa alt (per damunt de 9) és un factor que per ell mateix fa difícil la vida dels organismes aquàtics. El valor del pH pot ser clau perquè un contaminant tingui un efecte més gran o més petit sobre els organismes presents. Per exemple, un pH baix afavoreix la presència de metalls pesants en solució en l'aigua, mentre que amb un pH alt la majoria dels metalls pesants (excepte el mercuri i el crom) tendeixen a precipitar-se.
Com el mesurem
El pH es mesura in situ amb un sensor de pH. En el nostre cas, l’aparell emprat és el multiparamètric YSI model 63.
Com es pot consultar
Els resultats de pH de l'aigua no es representen als mapes però poden ser consultats a les taules de paràmetres fisicoquímics.
Per què la mesurem
La temperatura és un factor bàsic de la vida en l'aigua. Tot i que la vida s'ha adaptat a les temperatures extremes, siguin baixes o molt altes, la majoria de les espècies viuen i es reprodueixen entre 10 i 25ºC. Cada espècie pot tenir una temperatura òptima de desenvolupament. A més, la temperatura afecta, igual que el pH, la sensibilitat dels organismes als contaminants que pot portar l'aigua.
Com la mesurem
La temperatura es mesura in situ amb el sensor que porten incorporat diferents aparells. El que fem servir nosaltres és el multiparamètric YSI model 63, i els seus valors s'expressen en graus centígrads (ºC).
Com es pot consultar
Els resultats de la temperatura de l'aigua no es representen als mapes però poden ser consultats a les taules de paràmetres fisicoquímics.
Per què el mesurem
Per als organismes aquàtics que respiren oxigen dissolt en l'aigua la concentració d'aquest element és un dels factors més determinants. La concentració d'oxigen dissolt disminueix quan l'aigua s'estanca i la turbulència minva, i quan la temperatura augmenta o l'altitud disminueix.
Però una de les causes que fan disminuir més la concentració d'oxigen dissolt és la presència de matèria orgànica a l'aigua. De manera natural, als rius pot haver-hi present una certa quantitat de matèria orgànica, provinent, per exemple, de la descomposició de fullaraca, però que és fàcilment oxidada pels microorganismes aerobis sense una repercussió important en l'oxigen dissolt en l'aigua. Però, com més augmenta la concentració de matèria orgànica, més s'incrementa el ritme del metabolisme d'aquests bacteris aerobis, de manera que de mica en mica esgoten l'oxigen present a l'aigua i acaben quedant aigües anòxiques (sense oxigen), en les quals els animals moren d'asfíxia. Valors d'oxigen inferiors a 5 mg/l ja suposen la desaparició de moltes espècies, excepte les adaptades a viure en aigües amb poc oxigen. Aquestes condicions solen donar-se, doncs, en llocs on hi han entrades de matèria orgànica d'origen antròpic (purins, aigües fecals, etc.).
A més, els valors que s'obtenen de la mesura de l'oxigen dissolt, ens poden servir per calcular l'índex de peixos que avalua la qualitat de l'aigua segons la Directiva europea 78/659/CEE, relativa a la protecció i millora de les aigües per a la vida dels ciprínids. Es marca com a condició mínima, referent a aquest paràmetre, un valor de més del 50% de saturació, o bé de més de 7 mg/l d'oxigen dissolt.
Com el mesurem
L’oxigen dissolt es mesura in situ, ja que varia segons la temperatura, l'agitació i altres característiques de l'aigua; per tant, es disposa d'aparells anomenats oxímetres per realitzar-la. Es prenen mesures en percentatge de saturació i en mg/l.
Com es pot consultar
Els resultats de l'oxigen dissolt a l'aigua no es representen als mapes però poden ser consultats a les taules de paràmetres fisicoquímics.
Per què els mesurem
El nitrit és una forma nitrogenada reduïda de grau d'oxidació intermedi entre el nitrat i l'amoni (cicle del nitrogen). La seva persistència al medi sol ser molt curta, ja que ràpidament es transforma en una d'aquestes dues formes segons l'oxidació del medi, de manera que representa habitualment només el 0,1% del nitrogen inorgànic total. Però el nitrit és tòxic per a molts organismes aquàtics en concentracions fins i tot ben baixes. Per exemple, en concentracions a l'aigua de 0,01 mg/l N-NO2– es considera que ja hi ha un risc per al manteniment de les poblacions de peixos ciprínids (Directiva europea 78/659/CEE). D'altra banda, a causa de la baixa persistència d'aquest compost a les aigües, unes elevades concentracions de nitrit indiquen un abocament proper d'aigües residuals.
Com els mesurem
La determinació de la concentració de nitrits es realitza al laboratoris i els resultats es mostren en mg N-NO2–/l.
Com els representem
Les concentracions de nitrits es representen als mapes de resultats en tres rangs que, a grans trets, poden indicar-nos el risc de toxicitat d'aquest contaminant per als organismes i la presència d'abocaments d'aigües residuals propers:
|
Símbol
|
Concentració de nitrit (mg N-NO2-/l) |
Interpretació
|
 |
< 0.01 |
Aigües netes. Sense abocaments propers. |
 |
0,01 - 0,1 |
Aigües amb risc de produir efectes tòxics per a alguns organismes. |
 |
> 1 |
Aigües contaminades i amb un elevat risc de toxicitat per als organismes. |
Per què el mesurem
L'amoni és una de les formes en què el nitrogen inorgànic es pot trobar als sistemes aquàtics. L'amoni és la forma més reduïda en què trobem el nitrogen a l'aigua (cicle del nitrogen). En aigües naturals, ben oxigenades, l'amoni sol representar el 13% del nitrogen inorgànic total, i és la forma nitrogenada més utilitzada per molts productors primaris, bacteris i fongs. La seva biodisponibilitat per als organismes autòtrofs, doncs, és important, però cal tenir en compte que, quan apareix en concentracions massa elevades, pot esdevenir tòxic per a altres organismes. La presència de quantitats d'amoni anormalment elevades als medis aquàtics sol ser deguda a abocaments de diverses procedències, tant puntuals com difusos. Les aigües residuals no depurades poden aportar amoni directament als rius, així com les aigües que provenen d'estacions depuradores convencionals, tant de tipus fisicoquímic com biològic. L'amoni també pot procedir de l'agricultura, per via difusa; aquestes entrades als sistemes fluvials són encara més difícils de controlar o tractar que les entrades puntuals. La presència d'amoni, però, també es pot deure de manera indirecta a aportacions d'altres formes nitrogenades, principalment nitrats. Les elevades concentracions de nitrats al medi afavoreixen una producció primària molt elevada, que pot contribuir a esgotar l'oxigen dissolt a l'aigua i que, de retruc, comporta la transformació del nitrat en amoni.
L'amoni és tòxic per a molts organismes aquàtics en concentracions relativament baixes i en medi aquós l'amoni està reaccionant amb l'aigua segons la fórmula següent, que es manté en equilibri si no varia el pH ni la temperatura:
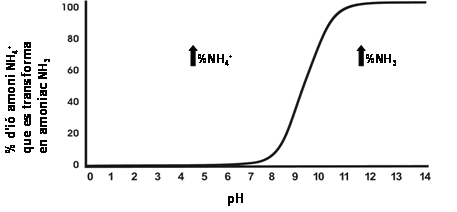
Aquesta reacció es veu desplaçada segons el pH del medi seguint una tendència com la del gràfic de la dreta.
A partir d’un pH de 7 o 8, l’amoni (NH4+) té molta més tendència a perdre un protó (H+) i passar a amoníac (NH3), que és la forma més tòxica per als organismes vius.
Pel que fa als macroinvertebrats, s'observa la reducció de la biodiversitat en presència d'amoni en concentracions properes a 1 mg/l. En concentracions fins i tot més baixes, es veuen fortament afectades les poblacions de peixos. De forma general, podem dir que en concentracions inferiors a 0,1 mg/l la vida aquàtica no es veu afectada. Entre 0,1 i 0,4 mg/l, concentracions que es poden trobar de manera natural en determinats ambients, tampoc no s'observa toxicitat si el pH es manté entre 6 i 8, però pot haver-hi risc a pH superiors a 8. Entre 0,4 i 1 mg/l, encara es permet la vida dels peixos ciprínids, però poden començar a aparèixer símptomes de toxicitat depenent del pH, especialment per als salmònids. Finalment, per sobre d'1 mg/l d'amoni, tant els peixos com els macroinvertebrats es veuen afectats, i és per damunt dels 4 mg/l que la toxicitat es considera molt forta (vegeu la taula de llegenda).
Com el mesurem
La determinació de la concentració d’amoni es realitza al laboratoris i els resultats es mostren en mg N-NH4+/l.
Com el representem
Les concentracions d'amoni es representen als mapes de resultats en cinc rangs que, a grans trets, poden indicar-nos el grau de toxicitat d'aquest contaminant per als organismes:
|
Símbol
|
Concentració Amoni (mg N-NH3/l) |
Interpretació
|
 |
< 0.1 |
Aigües netes. Sense risc de toxicitat per als organismes. |
 |
0,1 - 0,4 | Aigües on el risc de toxicitat pot ser significatiu depenent del pH i del temps de permanència. |
 |
0,5 - 0,9 |
Aigües amb risc de toxicitat si el pH és alt. |
 |
1-4 | Aigües que comporten un risc de toxicitat elevat per a moltes espècies, sobretot a pH > 8. |
 |
> 4 |
Aigües amb un grau de toxicitat agut per als organismes. |
Per què els mesurem
El nitrat és un nutrient bàsic per al creixement dels productors primaris, algues i plantes aquàtiques (vegeu el cicle del nitrogen). Les concentracions de nitrats al medi depenen, sobretot, de la matèria orgànica que s'hi descompongui de manera natural, incloent-hi la que és autòctona del medi aquàtic (produïda en aquest), i també l'al·lòctona (que ve de fora, com ara fulles que es descomponen). Depenent del grau de productivitat d'un medi, s'hi desenvoluparan unes comunitats o unes altres, tant de productors primaris com de tots els seus consumidors: directes (els herbívors) i indirectes (els carnívors). Les concentracions de nitrats massa elevades poden provocar el creixement excessiu d'algunes espècies d'algues —l’eutrofització—. En aquest sentit, concentracions baixes de nitrats normalment estan associades a sistemes en un estat natural o proper a aquest, mentre que concentracions elevades seran més pròpies de sistemes pertorbats.
Com els mesurem
La determinació de la concentració de nitrats es realitza al laboratoris i els resultats es mostren en mg N-NO3–/l.
Com els representem
Les concentracions de nitrats es representen als mapes de resultats en tres rangs que, a grans trets, poden indicar-nos el risc que hi ha que es produeixi eutrofització del medi:
|
Símbol
|
Concentració de nitrats (mg N-NO3-/l) |
Interpretació
|
 |
< 0.67 |
Aigües netes. Sense risc de produir eutrofització. Sense abocaments propers. |
 |
0,67 - 10 |
Aigües amb risc de produir eutrofització. |
 |
> 10 |
Aigües contaminades. Amb risc de produir forta eutrofització. |

